单细胞越来越火,研究的人也越来越多,相信单细胞技术会极大的推荐基础理论研究的拓展。硕士就读的学校,主要是研究医学相关的细胞生物学,当时毕业的时候就传闻学院大佬要引进单细胞测序平台。也不知道现在如何了
单细胞测序
为什么关注单细胞
单细胞越来越火,研究的人也越来越多,相信单细胞技术会极大的推荐基础理论研究的拓展。硕士就读的学校,主要是研究医学相关的细胞生物学,当时毕业的时候就传闻学院大佬要引进单细胞测序平台。也不知道现在如何了。刚刚问了师弟,还是在准备引入。
不过怎么说,单细胞测序可以让我们获得细胞层面上的信息。甚至结合抗体技术和酶切技术,达到特异结合和筛选某种特定类型的基因片段。从而在单细胞平台上,可以进一步扩展。比如VDJ、ATAC等等。
总之,个人觉得这是引领最近五年的技术之光。新的、好的技术当然要跟的上发展,否则是要被淘汰的。可怕。
单细胞测序的平台
单细胞测序从北大的汤富酬课题组开始[1], 到今日, 单细胞测序技术已经发展了十年, 这十年内(09-19),诞生了很多不同的测序技术。其中最著名的:一个是Fluidigm公司的C1测序平台。另一个是10xgenomics公司的Chromium单细胞测序平台。
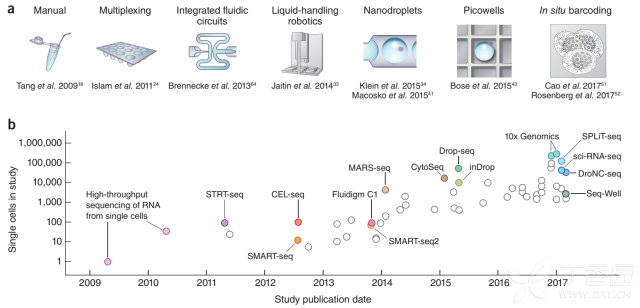
从最开始的检测几个细胞一直到10xgenomics、CEL-seq、MARS-seq,Smart-seq2等技术的兴起,到目前普遍的CNS级别文章的百万级别的单细胞测序。可以说,单细胞是目前测序领域中最火热,技术迭代最快的技术。
Fluidigm C1单细胞测序(微量建库)
Fluidigm C1平台,是最早被应用于Single Cell领域的商业化单细胞测序技术,大约在几个小时中可以捕获96个左右的细胞,进行各类的Single-Cell测序建库。当然,通量还是比较小。
并且我们要有一个清晰的认识:
基于Fluidigm C1的Smart-seq测序技术, 其实真正的技术本质是微量建库. 因为采用了活性极高的高保真聚合酶以及针对扩增全长的特异性引物. 可以保证Smart-seq测序在极低的模板起始量(皮克级)下, 达到一个很好的测序效果.
但是因为Smart-seq通量低, 单个细胞的测序价格昂贵, 所以一般测序的时候都是采用2-4个细胞混合测序的策略.
万一某个细胞不正常呢,是吧.
惨兮兮

10X Genomics测序平台
通量低,单个细胞的成本高也是14年之前,影响单细胞测序技术普及的主要因素,令人亢奋的是,在2014-2015年间几个性技术诞生了,仿佛寒武纪大爆发一般,MARS-Seq、CytoSeq、Drop-Seq、inDrop技术在这两年中扎堆出现,真正引爆了Single-Cell这个领域。而在2017-2018年,商业化的测序平台(10X Genomics®, BD Rhapsody®),逐渐浮出水面,才最终让Single-Cell测序技术走进了大众。

经过上面这么一说,我觉得两者就不用放在一起比较了。明显的事情…..但是我们可以说一说,14年之后的单细胞测序技术之间的主要差异[2]。
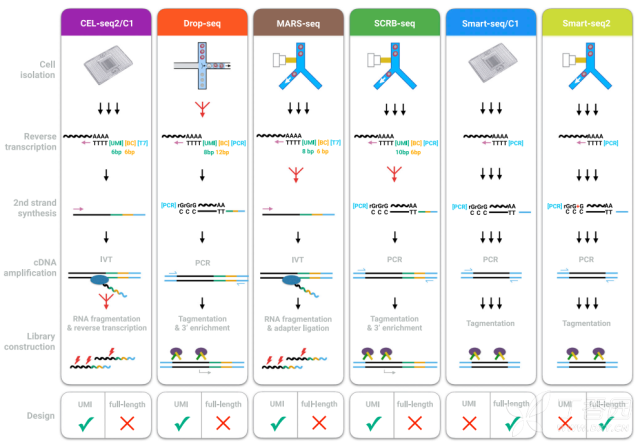
主要讲讲两个现在的主流技术,BD Rhapsody以及10X Genomics。从诞生年代来看,两者不分伯仲,10X Genomics起源自Drop-Seq技术,得益于哈佛大学研究所的工作。
10X Genomics和Drop-Seq具有类似的技术原理。从横向孔道中逐一输入凝胶微珠,第一纵向孔道输入细胞,凝胶微珠与细胞碰撞后会吸附在凝胶微珠上,并通过微流控技术,将之输入到第二纵向孔道,即油相孔道中。这时候,就形成了一个个油滴,最终输出并收集在EP管中。每一个油滴中会落入一个细胞以及一个凝胶微珠,那么在每一个凝胶微珠中上长满了不同的Cell Barcode和``UMI Barcode连接形成的序列,再加上一端PolyT的抓手,构成我们的捕获凝胶微珠。而这个凝胶微珠抓手就会使用oligo dT抓住mRNA`构建文库。
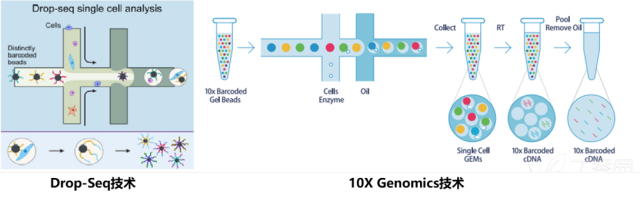
BD的技术不再采用利用微流控孔道射出细胞和射出的磁珠碰撞的过程,进行单细胞捕获的技术,转而采用CytoSeq特有的蜂窝板技术。该技术用*20W+*的微孔(该数量级远大于Input细胞数量),保证单孔中的单细胞捕获。同时避免了10X中存在的概率碰撞影响捕获效率的问题,采用微孔捕获相对会有更好的捕获效率(来自两家企业商业宣传资料比对),保证Input细胞的全面使用。
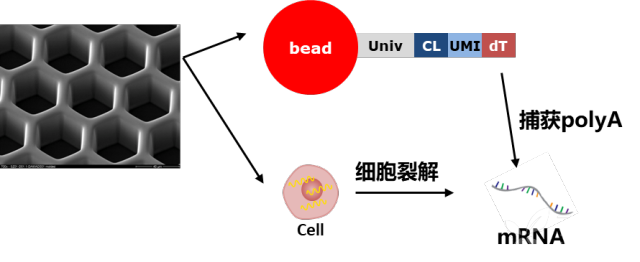
以上关于10x和BD的资料主要来自烈冰生物的公众号:
我们主要介绍10x技术的建库测序和分析内容
| 10X Genomics 単细胞DNA | 10X Genomics 单细胞RNA | 10X Genomics 単细胞免疫组库 | BD Rhapsody 单细胞 |
|---|---|---|---|
| 単细胞CNV检测 | 单细胞3’转录组测序检测 | 单细胞TCR+5’基因表达检测 | 定制灵活单细胞靶向基因表达检测 |
| 单细胞ATAC检测 | 单细胞5”转录组测序检测 | 单细胞BCR+5’基因表达检测 | 单细胞蛋白组及转录组联合检测 |
| 单细胞TCR+BCR+5’基因表达检测 |
提取和建库
目前主要用的10x的The Chromium Single Cell Gene Expression Solution。所以下面主要讲的是10x的Chromium文库制备。
步骤1 GEM生成和标签化
- 配置单细胞反应混合液
- 单细胞
3‘芯片加样

- 运行
Chromium controller制备GEMs - 将制备好的GEMs转移到PCR管内
步骤2 GEM反转录以及纯化
GEMs-RT孵育体系在PCR仪上进行- 反转录体系的纯化(
Silane DynaBeads) cDNA扩增反应(实验室常说的第一轮pcr扩增)
PCR循环数可以根据细胞的数量进行调整
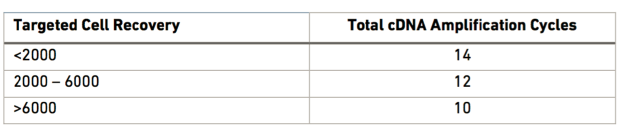
- Post cDNA扩增反应纯化-
SPRIselect - cDNA扩增后的质控
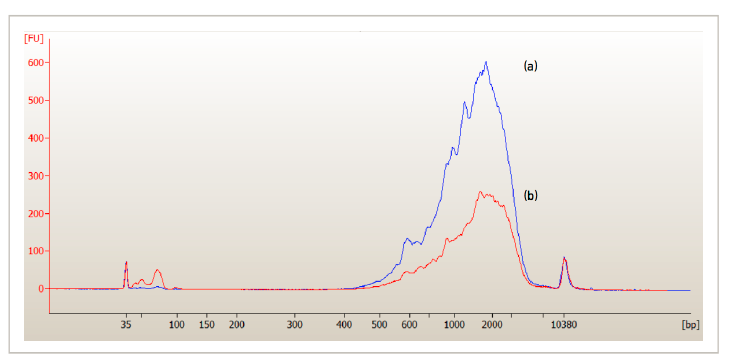
步骤3 文库构建
- 配置
Fragmentation Mix,设置程序。在体系里进行断裂、末端补平、加A - 纯化(
SPRIselcet) - 加接头
- 纯化(
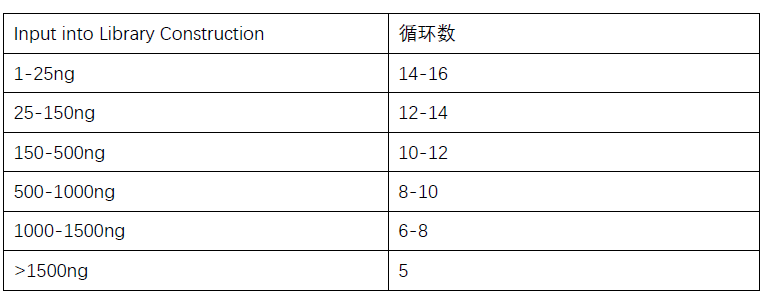
SPRIselcet) - PCR加入样本的
sample index(第二轮PCR)
- 纯化(
SPRIselcet) - 文库质检
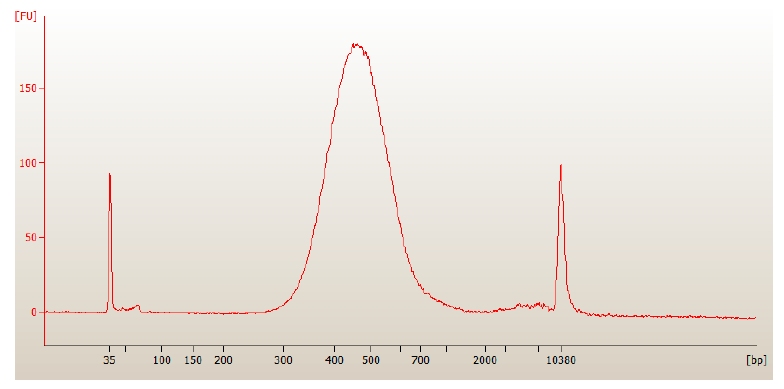
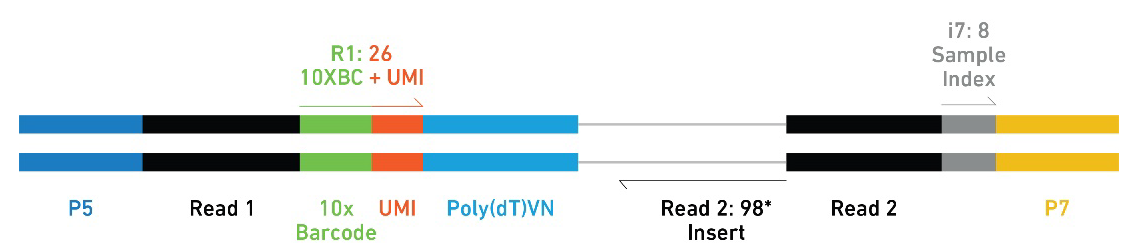
步骤4 文库测序
构建完成的文库包含完整的 Illumina P5和P7末端。单细胞3' V2 16bp的barcades位于Read1的起始点。样本 Index 称为 i7 index read。Read1和Read2是标准的,用于成对的测序引物位点。Read1用于16bp Barcode和10bp的UM测序,反之,Read2 用于插入的 cDNA 测序。而区分样本的sample index则本身就有已经平衡的8bp的核酸序列。
单细胞转录组的文库的测序覆盖度一般推荐是50000 raw reads/细胞。根据选用的测序平合,调整上样浓度单细胞文库。其实这一步就是就是普通的二代测序了,已验证的测序平台有illumina Miseq、 Nextseq500/550和 Hiseq 2500。
建议测序长度(循环,这个循环不是PCR循环,而是SBS测序系统中的合成—洗脱—合成)

同时下图的透漏了这一理论基础,index和接头序列的多样性和长度是匹配的。
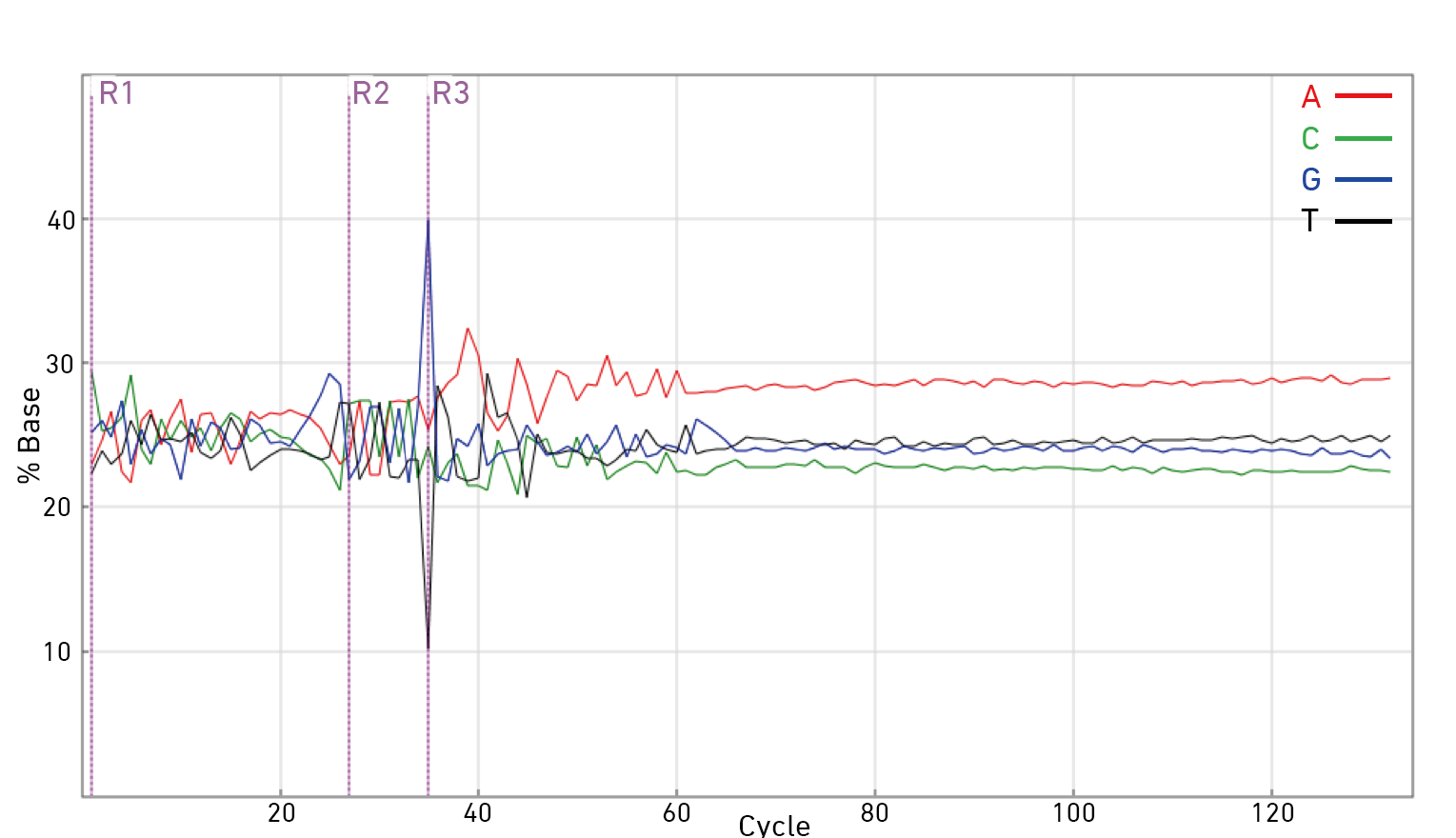
做一次10x的建库和测序需要花费的时间周期:
